Ce dossier a été enregistré dans l’épisode 253 de podcast Science
Définition de la PMA
Il s’agit de l’acronyme de “procréation médicalement assistée”, elle est définie comme “l’ensemble des techniques permettant à un couple infertile de concevoir un enfant.” On parle également d’assistance médicale à la procréation (AMP).
La procréation du coup ça marche comment encore ?
Je vais commencer par un petit rappel sur la reproduction humaine parce que sinon ça va être beaucoup moins pratique pour comprendre la suite. Les femmes naissent normalement avec des ovaires contenant des ovocytes.
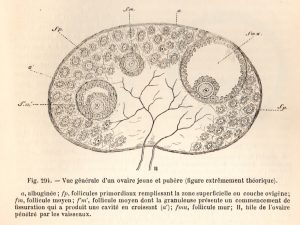
Petit rappel en schéma, on voit donc un ovaire, avec de nombreux petits follicules contenants des ovocytes, on voit également 3 follicules à différentes phases de maturation. A la naissance une femme dispose d’une réserve d’environ 500 à 700 mille ovocytes, pourtant il n’y a en moyenne que 400 ovulations au cours d’une vie reproductive. 99,9% des ovocytes disparaissent donc sans que l’on sache pourquoi ou comment. Cette disparition constitue un enjeu scientifique important entre autre dans la question de l’insuffisance ovarienne précoce (IOP).
A partir de la puberté les ovocytes grandissent dans les follicules ovariens. Les cellules folliculaires produisent une hormone qui conduit au déclenchement du signal d’ovulation, normalement tous les mois hors prise de contraception, à ce sujet je vous renvoie au très bon dossier d’Irène sur la pilule. La théorie veut que l’ovulation se produise au 14ème jour du cycle menstruel mais en pratique la durée des cycles et la date d’ovulation sont souvent moins précises que cela.

Revenons à l’ovocyte, après son expulsion de l’ovaire, et sa descente dans la trompe de Fallope. il est fécondable durant 24 heures. Je vous remets ici un petit schéma pour ceux qui se souviennent mieux des cours de math que de bio, les trompes de Fallope ce sont donc les conduits qui relient les ovaires à l’utérus. S’il est fécondé, l’ovocyte est alors appelé ovule, après la fécondation, les trompes de Fallope assurent le déplacement de l’ovule vers l’utérus, où il peut s’implanter dans la muqueuse utérine (qu’on appelle l’endomètre). Si ce déplacement ne se fait pas ou pas bien, l’embryon peut poursuivre son développement dans les trompes, les ovaires ou même l’abdomen, ce phénomène est appelé grossesse extra-utérine (GEU) et peut être extrêmement dangereux.
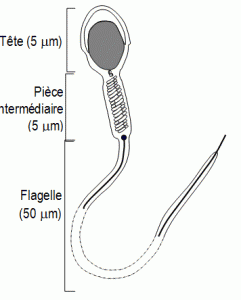
Du côté masculin, la spermatogenèse, c’est à dire la production de spermatozoïdes, a lieu dans les tubes séminifères des testicules. Elle débute à la puberté, atteint son maximum entre 20 et 30 ans, ralentit ensuite mais peut se poursuivre jusqu’à un âge avancé. Il s’agit d’un processus continu qui demande environ 2,5 à 3 mois. Un spermatozoïde normal se compose de deux parties : la tête et le flagelle, séparées par le collet. La tête contient le noyau d’ADN. Un éjaculat a un volume de 1,5 à 5 ml et contient habituellement de 39 à 75 millions de spermatozoïdes. (> 20 10^6 pour que ce soit normal.)
La probabilité d’une grossesse lors d’un rapport non protégé en période d’ovulation est d’environ 25%. Que ça vous paraisse peu ou beaucoup, je conseille au public qui n’est pas en PMA de ne pas tabler uniquement sur les probabilités pour éviter une grossesse.
Définition de l’infertilité
Il s’agit de l’incapacité pour un couple à concevoir un enfant. Un couple est considéré comme infertile au bout d’un à deux ans d’essais non protégés n’ayant pas abouti à une grossesse ou si les grossesses n’aboutissent pas à la naissance d’un enfant vivant.
Un couple sur six consulte pour infertilité. Les résultats obtenus lors des bilans de fertilité donnent que dans 30 % des cas l’infertilité est d’origine féminine, dans 30 % d’origine masculine et dans 30 % d’origine mixte. Pour les 10 % restants, le bilan de fertilité du couple est normal et on parle alors d’infertilité inexpliquée. Les causes les plus fréquentes d’infertilité d’origine féminine sont l’absence ou les troubles de l’ovulation et l’obstruction des trompes de Fallope, ces problèmes peuvent être dus à différents facteurs tels que l’âge, les infections sexuellement transmissibles, des malformations génétiques, le syndrome des ovaires polykystiques, l’endométriose, l’exposition au distilbène in utero, etc.
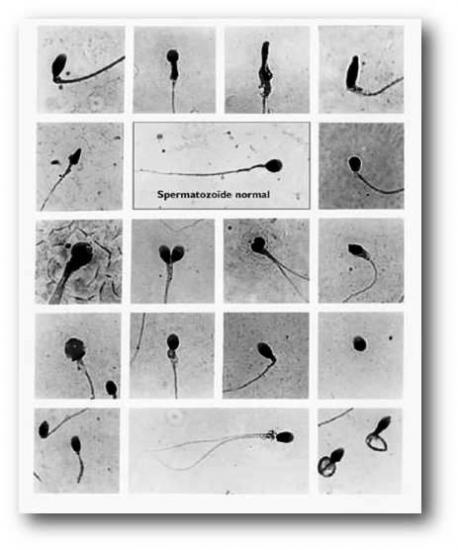
Chez les hommes c’est la réduction du nombre, de la mobilité ou de la qualité des spermatozoïdes qui peuvent être des causes d’infertilité. Ceci peut être dû à de nombreux facteurs comme l’hygiène de vie, les maladies infantiles, l’exposition environnementale… Entre les années 1940 et 2000 il a été constaté un déclin des paramètres spermatiques et du nombre de spermatozoïdes chez les hommes dans les pays occidentaux, il n’y a pour le moment pas de consensus scientifique sur les raisons de ce déclin. On parle d’azoospermie lorsqu’aucun spermatozoïde n’est produit. Les spermatozoïdes anormaux peuvent présenter plusieurs têtes, ou une tête trop petite, trop grosses, triangulaire, des flagelles malformés, doubles ou absents et d’autres particularités que vous voyez sur l’image ci-contre.
En fonction des raisons de l’infertilité, les techniques de PMA utilisées sont différentes.
Histoire de la PMA
Les expérimentations sur le stockage de sperme auraient commencé au XVIIIe siècle, un prêtre italien, Lazzaro Spallanzani proposa notamment de congeler du sperme humain dès 1776 et réussit une insémination artificielle sur une chienne.
La première insémination artificielle intra-conjugale aurait eu lieu fin du XVIIIe siècle en Ecosse. En 1866 le Dr. James Marion Sims, gynécologue américain, rapporte le succès d’une insémination artificielle conduisant à la naissance d’un enfant. En 1890 Walter Heape, de l’Université de Cambridge, rapporte le premier cas de transplantation d’embryons de lapin. En 1932 Aldous Huxley décrit la technique dans son livre Brave New World, “Le meilleur des mondes” en français. En 1934 Gregory Pincus, co-inventeur de la pilule contraceptive, mélange des ovocytes et des spermatozoïdes de lapin et transplante les embryons obtenus dans l’utérus d’une lapine porteuse, mais aucun autre scientifique ne parvient à reproduire l’expérience. En 1944 à Boston, Miriam Menkin et John Rock (l’autre inventeur de la pilule contraceptive) récoltent plus de 800 ovocytes de femmes, et ils observent pour la première fois la fécondation in vitro de gamètes humains. Ce n’est qu’en 1959 que M. C. Chang, arrive à reproduire l’expérience de Pincus, en obtenant la naissance de lapins vivants d’une lapine blanche à partir d’embryons obtenus à partir de gamètes de lapins noirs.

Source : The Times
Photo de Duncan Baxter
La première grossesse humaine suite à une FIV a été rapportée en 1973 à Melbourne, mais elle a résulté en une fausse couche très précoce, moins d’une semaine de grossesse.En 1976 les anglais Patrick Steptoe et Robert G. Edwards, publient un rapport sur une grossesse extra-utérine obtenue après un transfert d’embryon. En 1978, grâce aux travaux de Steptoe et Edwards nait Louise Brown, première enfant née suite à une fécondation in vitro (FIV). Robert Edwards a obtenu en 2010 le prix Nobel de médecine pour leurs travaux. Ensuite il y a eu les premières grossesses issues d’embryons congelés, de nouveaux traitements, de nouvelles techniques, etc.
Les techniques
Il existe différents traitements en fonction du type de pathologie dont souffre l’un ou les deux membres du couple, et je vais les détailler dans l’ordre croissant d’intervention, de la plus, si l’on peut dire légère, à la plus lourde.
La stimulation ovarienne simple.
Elle permet de palier un problème hormonal et vise soit à rétablir une ovulation, soit à augmenter le nombre de follicules arrivant à maturité. Elle permet également la préparation de l’endomètre pour l’implantation de l’embryon. Cette technique est utilisée lorsqu’une femme a des problèmes d’ovulation qui peuvent être résolus par une “simple” stimulation et que la qualité spermatique de son conjoint est suffisante pour qu’une conception naturelle soit possible suite à la provocation de l’ovulation. Celle-ci est provoquée par la prise d’un médicament permettant la production d’hormone folliculo-stimulante par l’organisme. Cette hormone stimule la croissance des follicules et la maturation des ovocytes. Le but est de faire grossir un ou deux follicules au maximum.
Quinze jours après l’ovulation, un test sanguin est effectué pour détecter une éventuelle grossesse, il permet de mesurer le taux de béta-HCG (Hormone Chorionique Gonadotrope) laquelle est secrétée par le placenta à partir de l’implantation de l’embryon dans l’utérus. Durant ces quinze jours il est également fréquent qu’un traitement à base de progestérone soit prescrit afin de soutenir la nidation. La stimulation ovarienne peut être répétée un certain nombre de fois si elle n’aboutit pas à une grossesse, généralement au bout de quelques échecs il est proposé aux couples de tenter une insémination artificielle. La probabilité de grossesse par cycle est d’environ 10 à 20%.
L’insémination artificielle
Elle est indiquée lorsque les spermatozoïdes ont des difficultés à arriver dans l’utérus et dans le cadre de problèmes ovulatoires, d’altérations anatomiques et/ou fonctionelles du col de l’utérus ou les infertilités d’origine inconnue. La stimulation des ovaires est réalisée au moyen d’injections quotidiennes d’hormone folliculo-stimulante. Comme pour la stimulation simple le but est d’obtenir un ou deux follicules dominants. Au moment de l’ovulation, l’échantillon de sperme, contenant au minimum 1 million de spermatozoïdes, est déposé dans la cavité utérine à l’aide d’un cathéter en passant par le col de l’utérus. Comme vous le voyez sur le schéma suivant. La suite de la fécondation se passe de manière normale dans la trompe de Fallope. Les probabilités de grossesse avec cette technique sont de 10 à 20% par insémination.
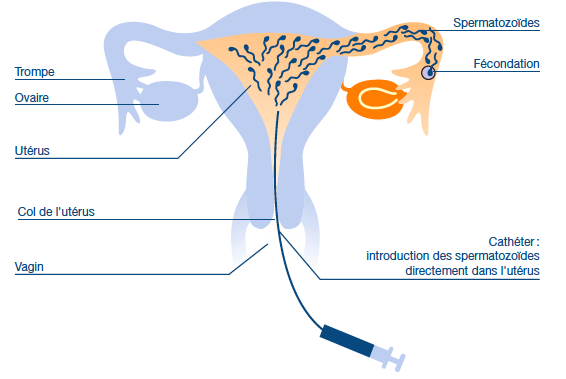
Source : Centre de PMA de Lausanne, www.cpma.ch
En France et en Belgique le nombre maximal d’insémination qui seront remboursées est de 6, sachant qu’en France après chaque grossesse un couple dispose à nouveau de la possibilité de réaliser jusqu’à 6 inséminations, en Belgique il est figé pour chaque femme quelque soit le nombre de grossesses. Il est également possible de changer de technique après une ou plusieurs inséminations sans aller jusqu’à 6, en fonction de la réponse au traitement. On parle d’IAC Insémination Artificielle avec le sperme du Conjoint ou d’IAD, IA avec le sperme d’un Donneur.

Source : Agence de la biomédecin
L’insémination artificielle avec don de sperme est recommandée lorsque l’homme présente des maladies héréditaires, est stérile, ou bien lorsqu’il n’y a pas de partenaire masculin. En fonction des pays les donneurs sont anonymes ou non, leur identitié peut-être connue lors de la commande des gamètes ou à la majorité de l’enfant sur demande de celui-ci. Le don peut également être gratuit comme en France ou rémunéré comme au Danemark ou aux USA. Le nombre de dons par homme est limité. En effet après avoir conduit à la naissance d’un certain nombre d’enfants (jusque 10 dans certains pays), le sperme d’un donneur n’est plus utilisé afin d’éviter les risques de consanguinité. La probabilité de grossesse par IAD est d’environ 30% par insémination, c’est plus que pour les IAC car les donneurs sont testés et les hommes infertiles sont écartés
La fécondation in vitro (FIV)
La FIV c’est la grosse artillerie des traitements de la procréation, on la garde pour la fin quand on a épuisé les autres techniques ou pour les cas trop compliqués pour celles précédemment citées. Elles est utilisée par exemple lorsque les trompes de Fallope sont absentes ou bien trop endommagées pour permettre à l’ovocyte d’être transporté. Mais aussi lorsque les spermatozoïdes ne peuvent atteindre l’ovocyte seuls. Une FIV se déroule en trois phases, d’abord une phase de blocage des ovaires, afin d’éviter une ovulation spontanée et contrôler les effets de la stimulation. En fonction des protocoles et de la réponse au traitement ce blocage peut durer de quelques jours à plusieurs semaines, à raison d’injections d’hormones quotidiennes. Le but lors d’une FIV est d’obtenir des embryons à transférer, pour ce faire on essaie de maximiser le nombre et la qualité d’ovocytes matures récoltés, via une stimulation ovarienne. Il s’agit de la deuxième phase du traitement.
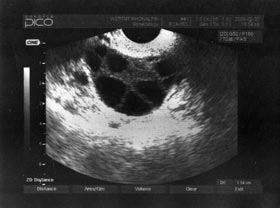
Source : Institut Rhône Alpin pour la reproduction humaine.
Vous pouvez voir sur la photo suivante un ovaire contenant plusieurs grands follicules après 25 jours de stimulation. Ils font en moyenne 18mm… Normalement on voit un seul follicule dans un ovaire. Lorsque le nombre et la taille des follicules conviennent, on passe à la troisième phase, le déclenchement de l’ovulation. Elle est provoquée 32 à 36 heures avant l’heure prévue de la ponction. Suite à ce déclenchement les ovocytes sont donc prélevés au sein des follicules, sous anesthésie locale ou générale.
On utilise donc une aiguille de ponction qui permet d’atteindre les follicules ovariens, à travers la paroi vaginale. Sous contrôle échographie, l’aiguille est introduite dans chaque follicule et le liquide qui est recueilli et contient les ovocytes est mis en culture dans un incubateur. Le nombre d’ovocytes récoltés est en moyenne de 10 mais il peut varier de 0 à plusieurs dizaines, même si les recueils à plus de 15 ovocytes sont plus rares. Le recueil du sperme est réalisé le même jour que la ponction des ovocytes. Il est ensuite “préparé” pour la FIV, c’est à dire lavé, centrifugé, concentré,… Maintenant qu’on a d’un les côtés les spermatozoïdes et de l’autre côté les ovocytes, différentes techniques de fécondation peuvent être mises en oeuvre.
Dans le cadre de Ll fiv classique, chaque ovocyte est mis en présence de 50 à 100 000 spermatozoïdes mobiles avant d’être replacé à 37 °C dans un incubateur. Avec cette méthode, la sélection des spermatozoïdes par l’ovocyte est naturelle, elle présente néanmoins le risque d’aboutir à un faible taux ou une absence complète de fécondation si les spermatozoïdes ne parviennent pas à franchir les membranes protégeant l’ovocyte, par exemple parce que leurs têtes sont anormales. Vous voyez sur l’image suivante les structures qui entourent l’ovocyte et les spermatozoïdes qui les pénètrent
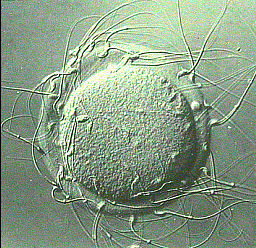
Source : www.biologydiscussion.com
FIV avec injection intra-cytoplasmique (ICSI)
Pour contrecarrer ce problème on peut réaliser une FIV-ICSI. Quand on vous dit FIV et que vous pensez à l’image d’une aiguille qui rentre dans un ovocyte comme ci-dessous, il s’agit en fait d’une FIV ICSI.
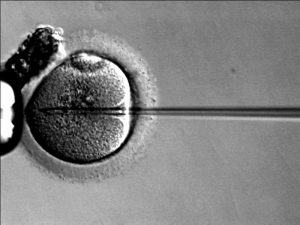
Cette technique a été utilisée chez l’homme pour la première fois en 1991. Elle permet d’améliorer les taux de fécondation et de grossesse lorsque les spermatozoïdes présentent des anomalies sévères. Les spermatozoïdes mal formés ont en effet du mal à passer les structures protégeant l’ovocyte que vous venez de voir, du coup on contourne ce problème en enlevant ces membranes et en introduisant directement le spermatozoïde dans l’ovocyte. Contrairement à la FIV classique il n’y a ici plus de choix de gamète effectué par l’ovocyte. Certains scientifiques estiment qu’un pourcentage non négligeable des infertilités masculines “gérées” par ces FIV-ICSI pourraient être traitées en amont en travaillant plutôt sur la fertilité masculine. Ce qui est relativement peu fait pour le moment.
Afin d’améliorer la sélection des spermatozoïdes on peut utiliser des microscopes plus puissants (coucou Irène) afin de passer d’un grossissement 400x à 6000x. Cette technique est appelée FIV IMSI – Injection intracytoplasmique de spermatozoïdes morphologiquement sélectionnés. Elle permet de choisir les spermatozoïdes dont l’aspect morphologique est le plus normal possible, par exemple sans vacuoles, c’est à dire sur l’image suivante, les petites bulles que vous voyez sur l’image sur le spermatozoïde a vs b sans vacuole avec une tête bien lisse.

Source : CHU de Liège – centre de PMA http://cpma-ulg.be/
Revenons en à nos gamètes: 16 à 20h après la mise en fécondation, on peut distinguer les ovocytes fécondés appelés zygotes de ceux non fécondés. Les zygotes sont remis en incubateur pour une durée de 2 à 6 jours avant d’être transférés. Voici des photos du développement des embryons, à 4 cellules, 8 cellules, au stade de blastocyste et de morula

Source : Centre de PMA de Lausanne, www.cpma.ch
En fonction de la qualité des embryons, de l’âge de la femme, des précédentes réponses aux traitements et des politiques des différents centres de PMA, un ou deux embryons sont transférés dans l’utérus. Dans de rares cas, si les embryons sont de moindre qualités ou que plusieurs FIV ont échoué il arrive que trois embryons soient transférés. Les embryons surnuméraires sont congelés dans de l’azote liquide, on dit qu’ils sont vitrifiés, ils pourront être utilisés si le premier transfert n’aboutit pas, ou gardés pour une deuxième grossesse. Ils peuvent également être donnés à d’autres couples infertiles, à la science ou bien détruits.
Les taux de grossesse sont de 10 à 30% par FIV, le nombre de FIV remboursées en France est de maximum 4 par enfant, 6 en Belgique par femme. Au terme des procédures remboursées de 30 à 60% des patients ont obtenu une grossesse en fonction des tranches d’âge, le taux de grossesses diminuant avec l’âge des femmes. On considère 3 catégories d’âge, c’est en dessous de 35 ans que les résultats sont les meilleurs avec 60% de grossesses après 3FIV, entre 35 et 38 ans compris il y a une baisse des taux de grossesse principalement en ICSI, à partir de 39 ans les résultats sont deux fois moins bons (30% de grossesse), au delà de 42 ans les grossesses se font beaucoup plus rares quelques soient les traitements d’où l’arrêt de la prise en charge par les organismes de remboursement dans certains pays.
En cas d’insuffisance ovarienne précoce ou de trop mauvaise qualité des ovocytes, la même procédure peut-être appliquée à partir d’ovocytes d’une donneuse. Celle-ci suit donc le même traitement puis une fois ses ovocytes ponctionnés, ils sont mis en contact soit avec les spermatozoïdes du conjoint de la receveuse, soit dans le cas d’un double don de gamètes avec ceux d’un donneur. Un couple peut également recevoir des embryons donnés par un autre couple. Il faut savoir que les temps d’attente pour bénéficier d’un don sont longs en France, jusqu’à deux ans ou plus pour un don d’ovocyte. De ce fait il est fréquent que les couples se tournent vers l’étranger, Grèce, Espagne, République Tchèque Belgique,… où les traitements sont entièrement ou en partie à leurs frais.
En cas de maladie génétique chez les parents, la FIV peut-être couplée avec un processus appelé “diagnostic pré-implantatoire” (FIV DPI). Cette technique permet, après la fécondation de chaque ovule par un seul spermatozoïde (donc une ICSI) et avant l’implantation in utero, de diagnostiquer la présence d’éventuelles anomalies génétiques chez les embryons obtenus. Seuls les embryons ne présentant pas l’anomalie recherchée seront choisis pour le transfert. Le diagnostic se fait via l’analyse génétique d’une ou deux cellules du zygote prélevés par biopsie au troisième jour post-ICSI. Cette technique permet d’éviter à un couple se sachant porteur d’une mutation génétique de devoir subir une amniocentèse et le cas échéant devoir interrompre une grossesse suite à la détection de la maladie chez le foetus, elle permet également d’éviter les fausses couches à répétitions en cas d’anomalie grave, etc… Le principal risque associé à la FIV est l’hyperstimulation ovarienne. La forme bénigne se manifeste dans 20 % à 33 % des cycles de FIV, la forme modérée entre 3 % et 6 %, les formes graves entre 0,1 % et 2 %. Les symptômes peuvent aller d’un ballonnement abdominal bénin à une accumulation importante de liquide dans la cavité abdominale, des embolies et un syndrome de détresse respiratoire aigu pour les cas les plus graves.
Pour aborder très rapidement la partie technique de la Gestation Pour Autrui (GPA), il s’agit de transférer les embryons d’un couple à une femme dite “mère porteuse”, avec laquelle l’embryon n’a donc pas de lien génétique. En Europe, elle est tolérée en Belgique, aux Pays-Bas, en Pologne et en Slovaquie où aucune législation ne l’interdit. Elle a été légalisée en Roumanie, en Irlande et au Royaume-Uni. Dans le monde très peu d’Etats ont mis en place des législations pour encadrer la gestation pour autrui (Etat-Unis, Canada, Brésil, Inde…), elle est tolérée dans certains autres pays. Un certain nombre d’Etats l’ont interdite explicitement, dont la France.
Quelques informations supplémentaires :
En France, environ 2,5 % des enfants sont nés à la suite de traitement PMA chaque année, c’est à dire autour de 20.000 bébés. Depuis Louise Brown, 5 millions d’enfants seraient nés grâce à la PMA dans le monde.
Aux Etats-Unis plus d’un tiers des jumeaux et trois quarts des triplés sont dus à la PMA. En France seuls 10 % des grossesses multiples seraient dues à des ttt. En cas de grossesse triple ou quadruple, une réduction embryonnaire est généralement proposée. Le risque de ces grossesses étant la (très grande) prématurité.
La PMA est autorisée pour les couples de même sexe dans sept pays européens : la Belgique, le Danemark, l’Espagne, la Finlande, les Pays-Bas, le Royaume-Uni et la Suède. Mais également aux Etats-Unis, au Canada notamment. Je n’ai pas réussi à trouver de liste exhaustive de pays autorisant la PMA aux couples homosexuels, seulement l’adoption, mais certains pays, comme la France, autorisant l’adoption mais pas la PMA donc ça ne constitue pas un filtre suffisant…
Enfin, qu’en est-il de l’après PMA ? Les résultat de la dernière enquête en France auprès de patients ayant terminé un parcours PMA sans enfant donnent qu’en moyenne 5 ans après la fin des traitements, 30% des couples sont restés sans enfants, 10% ont poursuivi la PMA par d’autres moyens (étranger, FIV non remboursées,…), 10% ont adopté et 10% ont obtenu une grossesse naturellement.
Citation :
I’m not a wizard or a Frankenstein tampering with Nature. We are not creating life. We have merely done what many people try to do in all kinds of medicine—to help nature.
Je ne suis pas un magicien ou un Frankenstein qui manipule la nature. Nous ne créons pas la vie. Nous avons seulement fait ce que beaucoup de gens essaient de faire dans tous les domaines médicaux, aider la nature.
Patrick Steptoe
Sources :
Publis
Cooper, T. G. et al. (2010). World Health Organization reference values for human semen, Human Reproduction Vol.16, No.3 pp. 231–245
Claman, P., Shmorgun, D. (2011). Diagnostic et prise en charge du syndrome d’hyperstimulation ovarienne, Journal of Obstetrics and Gynaecology Canada, 268, 1-9
Kamel, R. M. (2013). Assisted Reproductive Technology after the Birth of Louise Brown. Journal of Reproduction & Infertility, 14(3), 96–109.
Kolettis, P. N. (2003). Evaluation of the Subfertile Man. Am Fam Physician, 67(10):2165-2172.
Maheshwari, A., Hamilton M., Bhattacharya, S. (2008). Effect of female age on the diagnostic categories of infertility, Human Reproduction 23 (3), 538-542.
Quaas, A., & Dokras, A., (2008). Diagnosis and Treatment of Unexplained Infertility. Reviews in Obstetrics and Gynecology, 1(2), 69–76.
Swan, S. H., Elkin, E.P. & Fenster, L. (1997). Have sperm densities declined? A reanalysis of global trend data. Environmental Health Perspectives, 105(11), 1228–1232.
Livres
Blyth, R. Landau, Third Party Assisted Conception Across Cultures: Social, Legal and Ethical Perspectives, Jessica Kingsley Publishers, 15 nov. 2003 – 288 pages
De Jonge J., Barratt C. L. R., Assisted Reproductive Technology: Accomplishments and New Horizons, Cambridge University Press, 11 juil. 2002 – 431 pages
Lipshultz L. I. , Howards S. S., Niederberger C. S., Infertility in the Male, Cambridge University Press, 24 sept. 2009 – 677 pages
Journaux
Laurent S. (2014, 3 octobre) PMA, GPA, quel pays autorise quoi ?, LeMonde.fr [Lien]
Delaisi de Parseval G. & Milliez J. (2011, 11 novembre) De l’autre côté du miroir, les berceaux vides de la fécondation in vitro, Liberation.fr [Lien]
En ligne
L’insémination artificielle en France : Les promoteurs de la méthode



