Dossier présenté dans l’émission #93
Il y a certaines maladies qui font beaucoup parler d’elles.
Infection par le VIH et cancer, par exemple. Dans le cas du VIH, l’impact en terme de santé publique est aujourd’hui à mon sens largement inférieur à la place qu’occupe cette maladie dans nos subconscients. Dans le cas du cancer en revanche, cette « psychose » est tout à fait justifiée par son impact de santé publique. Il s’agit de la première cause de mortalité en France. Paradoxalement, les maladies cardiovasculaires passionnent nettement moins les foules, à mon sens, bien que quasi tout autant meurtrières.
Alors pourquoi le cancer nous-angoisse-t-il autant ?
Mortel, universel, lié au quotidien, parfois incurable, ces caractéristiques sont partagées par beaucoup d’autres maladies. Qu’est ce qui dans le cancer nous fait aussi peur ?
Après mûre réflexion, je pense que c’est son caractère insidieux. Le cancer, comme beaucoup d’autre maladies est mortel, mais à la différence de beaucoup, il cache ses symptômes pendant longtemps, et lorsque les symptômes apparaissent, c’est qu’il est déjà trop tard.
De même, le cancer est lié à nos habitudes quotidiennes. Mais à la différence d’autre maladies, les facteurs de risque ne sont pas tous identifiés, et sont très nombreux. On peut très bien s’exposer des années sans s’en apercevoir… Et c’est ça qui rend cette maladie terrifiante.
Outre cette grande angoisse qu’il génère, il y a une idée aujourd’hui assez répandu, justifiée par le fait que beaucoup de cancers restent incurables, qui est qu’on ne comprend pas le cancer. Je trouve cette idée un peu exagérée.
Que sait-on exactement du cancer ?
Les cellules cancéreuses
On sait tous, enfin je suppose, que l’apparition du cancer est liée à des mutations de l’ADN qui induisent une prolifération de la cellule et qui conduisent à la formation d’une tumeur. Poussons les choses plus en détail.
Notre corps est organisé en organes. Les organes sont par exemple le coeur, les poumons, mais aussi la peau, les muscles. Les organes sont eux mêmes organisés en tissus. Qu’est ce qu’un tissus ? Un tissu est un ensemble de cellules semblables et de même origine, regroupées en ensemble fonctionnel, c’est-à-dire concourant à une même fonction.
Les cellules qui forment un tissus ont l’obligation de se renouveller, du fait de leur durée de vie souvent limitée (mais pas toujours, les neurones ne se renouvellent quasiment pas par exemple, quasiment pas car … http://www.larecherche.fr/content/recherche/article?id=16883 on a prouvé que des neurones se formaient encore dans le cerveau de l’adulte, sans pour autant savoir si ces neurones sont fonctionnels ou non).
Donc, au sein d’un tissus, il est nécessaire d’avoir certaines cellules qui se multiplient, formant de nouvelles cellules. On pourrait imaginer que toutes les cellules se multiplient, cependant ça n’est pas comme ça que ça se passe. Certaines cellules se multiplient, quand d’autres ne se multiplient pas.
Prenons l’exemple l’épiderme, ou le tissus superficiel de la peau, la peau étant un organe, elle est composée de 3 tissus : l’épiderme, le derme, et l’hypoderme. Donc l’épiderme est organisé comme sur cette illustration :
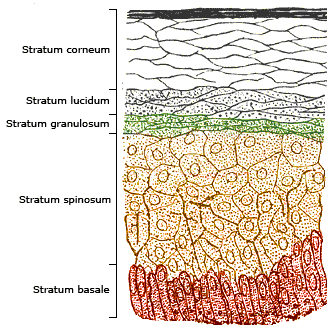
Il y a plusieurs couches de cellules (5 cellules), les kératinocytes les uns sur les autres. Seuls les cellules situées sur la couche la plus profonde se multiplient. En se multipliant, une moitié des cellules reste ancrée à ce qu’on appelle la lame basale, qui est un assemblage de grosses protéines enchevêtrées, et l’autre moitié est obligé de “monter”, se mettre au dessus, parce-que de toute façon, y a de place nulle part. Et au fur et à mesure des divisions cellulaires, les cellules les plus anciennes montent, de manière bien organisée. Pourquoi en “montant” les cellules ne se multiplient plus ?
Concrètement, c’est parce-qu’elles reçoivent l’instruction de ne pas le faire, nous y reviendront, mais fonctionnellement, c’est parce-que dès qu’elles quittent la basale, leur compte à rebours est enclenché : elles doivent mourir rapidement. Si elles ne meurent pas, voir continuent à se multiplier, une excroissance apparaît, car les cellules de la base vont elles aussi continuer à se multiplier, et on aura un amas de cellules, une excroissance. Cela donne un cancer des kératinocytes, (ça n’est pas un mélanome, qui concerne lui un autre type de cellule de la peau, contenues dans l’épiderme, les mélanocytes) :
Toute l’organisation spatiale de la peau est basée sur le “flux” de cellules de bas, la couche basale, en haut, la couche cornée, dont les cellules sont tellement différenciées qu’elles ne contiennent plus rien que de la kératine, même plus de noyau. Si on brise ce flux, tout le tissus se désorganise.
Voilà pourquoi la prolifération cellulaire, mais aussi, vous l’avez compris, la mort cellulaire, sont étroitement régulés au sein des tissus. Quels sont en bref les mécanismes de cette régulation ?
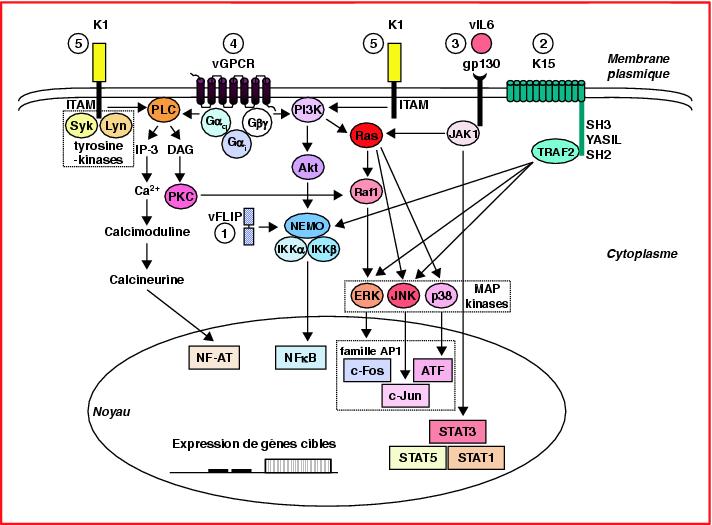
Pour faire simple, la plupart du temps ça se passe comme ça : une protéine est exprimée au niveau de la membrane de la cellule, qui reconnait une autre protéine, extérieure à la cellule. C’est un récepteur. Lorsque ce récepteur est fixé à son ligand, il change de forme. Une partie de ce récepteur est située à l’extérieur de la cellule, pour se lier avec son ligand, et une autre partie à l’intérieur. C’est un récepteur transmembranaire. Lorsque le récepteur change de forme, la partie intracellulaire change également de forme. Et acquiert une nouvelle propriété, comme une activité enzymatique, par exemple. La liaison du ligand va donc aboutir à la production par le récepteur d’une nouvelle molécule, à l’intérieur de la cellule. Bien souvent, cette molécule possède elle aussi une activité enzymatique. C’est à dire qu’elle va être à même de produire à son tour une nouvelle molécule. Ou elle va pouvoir activer ou inhiber l’activité d’une autre enzyme en se liant à elle. Et ainsi de suite, à de nombreuses reprises. On appelle cela une cascade de signalisation. Quel est l’effet final d’une cascade de signalisation ? Les possibilités sont nombreuses, mais bien souvent, la dernière protéines produite est ce qu’on appelle un facteur de transcription. Un facteur de transcription est une protéine qui a pour propriété de reconnaître spécifiquement un motif de l’ADN nucléaire, et de s’y amarrer pour augmenter, ou diminuer sa transcription en ARN, et donc modifier le phénotype de la cellule. Cela peut bloquer la mitose de la cellule, l’activer, ou au contraire faire entrer la cellule en apoptose (mort cellulaire programmée). Voici un exemple de cascade de signalisation.
En haut, on a les récepteurs, comme vGPCR. Lorsque le vGPCR est au contact de son ligand, elle libère au niveau intracellulaire, une petite sous-unité, comme G-alpha, qui va elle-même se fixer à une autre protéine, et induire la production d’une autre molécule, etc, etc… jusqu’à ce que soit activée des protéines appellées facteur de transcription qui vont aux directement agir au niveau du génome, en modifiant l’expression des gènes.
Pourquoi est-ce aussi complexe ? Parce-que ça permet de moduler la réponse cellulaire en fonction de plusieurs données. Il y a un veritable “calcul” moléculaire. C’est une forme de circuit électronique en quelque sorte, avec des transistors qui amplifient le signal, des diodes, des condensateurs, des résistances, etc… On peut également comparer ça a un réseau de neurones.
Que se passe-t-il si une des protéines de la cascade de signalisation n’est plus fonctionnelle, parce-que son gène a été modifié ? La voie de signalisation est altérée, et cela peut aboutir à des conséquences assez graves, selon l’importance de la voie de signalisation.
En fait, l’altération d’une seule protéine ne suffit généralement pas à la formation d’un cancer. Dans la plupart des cas, l’altération de la voie de signalisation rend la cellule non-fonctionnelle, et aboutit à sa mort rapide, ou apoptose, induite par des signaux internes, la cellule se rend compte d’elle-même que quelque chose cloche, et “décide” donc de mourir, avec altruisme, mais aussi externes, avec ce qu’on appelle les récepteurs de mort. Leur activation par un ligand, messager de mort, initie le processus d’apoptose.
Et on l’a vu, le seul processus de prolifération n’est pas le seul impliqué dans la cancérogénèse. Il y a aussi l’apoptose, par exemple. En fait, on a identifié 6 processus cellulaires qui doivent être altérés pour conduire à la formation d’une tumeur maligne. Ces 6 processus sont les suivants :
1- Indépendance vis à vis des signaux de prolifération provenant de l’environnement2- Insensibilité aux signaux anti-prolifératifs3- Résistance à l’apoptose4- Prolifération illimitée (perte de la sénescnece)5- Capacité à induire l’angiogénèse6- Capacité d’invasion tissulaire et diffusion métastatique
Les altérations génétiques aboutissant au cancer
Le génome de nos cellules est loin d’être un havre de paix. On a même pu estimer la fréquence des évênements qui survenaient au niveau d’une cellule : chaque heure, on estime que 5000 coupures de l’ADN simple brin ont lieu au sein d’une cellule, par exemple, 1000 dépurination (rupture du lien entre une base purique de l’ADN et le sucre auquel elle est rattachée), 55 dépyrimidation, 3500 méthylation de guanine, etc… Ces fréquences sont physiologiques, elles peuvent augmenter en cas d’exposition à un mutagène. A ces fréquences, il est largement admis que la cellule est capable de réparer son ADN.
Un des mécanismes permettant cette réparation est par exemple le mécanisme de l‘excision resynthèse.
Une molécule patrouille le long de l’ADN, détecte les anomalies dans l’appariement des bases, et coupe le brin d’ADN lorsqu’il en détecte. Ensuite, une ADN polymérase, enzyme chargée de la synthèse de l’ADN, revient synthétiser le brin défectueux.
Ici une molécule d’ADN liée à un benzopyrène (au centre), l’un des principaux toxiques contenus dans la fumée de la cigarette.
Chaque type de lésions de l’ADN dispose de sondes spécifique, des protéines, dont la forme leur permet de reconnaître et de lier les anomalies de l’ADN, et d’activer sa réparation par un système approprié.
Ainsi, notre ADN est en permanence en lutte contre les mutations et les atteintes à l’intégrité de l’information génétique. Comme bien souvent en biologie, les équilibres en places sont des équilibres dynamiques, avec une compensation des flux inverses, et non un équilibre statique. Dans la cellule, si la concentration intracellulaire de sodium est constante, cela ne signifie pas que la membrane est imperméable au sodium, mais qu’à chaque instant, il y a autant de sodium qui entre que de sodium qui sort. Un autre exemple d’équilibre dynamique.
Par ailleurs, outre ces mécanismes de réparation de l’ADN, il existe également de nombreux mécanismes de contrôle de l’intégrité de l’ADN. C’est à dire que la cellule sait réparer son ADN, mais elle est censée savoir également à quel point cet ADN est endommagé, et si ça vaut le coup de continuer à s’arracher les cheveux à tout réparer. Pour faire ça, il y a une protéine, super importante pour le contrôle de l’état de notre génome, c’est la protéine p53. Cette protéine est retrouvée mutée dans plus de 50% des cancers. Comment fonctionne-t-elle ? Comment la cellule fait pour savoir si elle est bon état ou pas ?
Lorsque les dommages à l’ADN augmentent, les sondes qui permettent de reconnaître les anomalies de l’ADN sont de plus en plus consommées : normal, elles sont liées à l’ADN. Cette diminution de différentes protéines sondes des dommages à l’ADN va déclencher la production de p53 par activation de sa synthèse à partir de l’ADN, mais également par un mécanisme tout simple, p53 est normalement liée à certaines des sondes. Quand elle est liée, elle est inactive. Comme le nombre de sondes diminue, le nombre de protéines p53 augmente et le tour est joué. C’est un des mécanismes qui conduit à l’augmentation de p53 en cas de dommages importants à l’ADN.
En fait, comme pour les voies de signalisation, il y a véritablement un calcul moléculaire qui va déterminer si oui ou non la cellule est en état d’entrer en mitose.
Maintenant que va faire cette protéine p53 ? Hé bien par différents mécanismes qu’on va pas détailler, elle va bloquer la prolifération de la cellule, notamment en agissant comme facteur de transcription, en allant directement se lier au génome, voire la faire entrer en apoptose. P53, c’est un peu la gardienne de notre génome.
Imaginons maintenant que les deux allèles de p53 soient mutés. Rien ne va se passer dans un premier temps. Mais si la cellule subit une agression de son génome, due à un agent extérieur, par exemple, cela peut commencer à causer des problèmes, car la cellule a perdu la capacité à bloquer sa prolifération en cas d’anomalie du génome.
On parle d’initiation tumorale. Les cellules initiées on soit perdu un gène suppresseur de tumeur, comme le gène de p53, ou ont acquis un oncogène. La différence est que les gènes suppresseurs de tumeurs induisent des tumeurs lorsqu’ils perdent leur fonction, alors que les oncogènes sont cancérogènes par acquisition de fonction, comme l’indépendance aux facteurs de croissance, par exemple.
Les cellules initiées peuvent ensuite acquérir de nouvelles mutations sans cesser de se multiplier, et le processus tumoral est enclenché, bien que encore réversible à ce stade.

Au cours de la phase suivante, la phase de promotion, les cellules initiées sont au contact de cellules normales, et ont toujours des mécanismes de réparation de l’ADN, ou d’apoptose fonctionnel. Pendant cet période, il y a toujours un équilibre dans le développement de ces cellules, qui présentent pourtant des anomales dites pré-cancéreuses. Elles restent régulées par les mécanismes classiques.
Les probabilités que d’autres gènes cruciaux soient touchés durablement sont en réalités faibles. Et c’est ce qui explique la longueur de ces phases de latence, qui restent toujours infracliniques, et indétectables.
C’est en réalité la sélection naturelle qui se fait acteur de ce processus. Pendant cette phase de promotion, les cellules vont se multiplier en nombre stable, jusqu’à ce qu’apparaisse des mutations induisant une prolifération plus délétère pour le reste de l’organisme. On entre alors en phase de progression tumorale : l’équilibre entre multiplication cellulaire et apoptose est rompu. La cellule devient néoplasique, elle a fini par acquérir suffisamment de caractères malins pour que sa prolifération soit dérégulée.
Finalement, le processus qui mène à la formation d’une cellule cancéreuse maligne est un processus très improbable. Les mutations qui doivent s’accumuler sont nombreuses, et les processus de réparation et de contrôle sont nombreux et généralement efficaces. Les mutations doivent apparaître dans un ordre assez précis, avec un taux de mutation suffisant pour déborder les mécanismes de contrôle, mais pas excessif pour que la cellule conserve sa capacité de prolifération.
Voilà donc comment le génome d’une cellule peut se retrouver suffisamment bousillé pour aboutir à un clone malin qui va proliférer dans le reste de l’organisme. Mais maintenant retournons à la source de toutes ces modifications qui peuvent frapper la cellule cancéreuse. Les cancérogènes.
Cancérogènes
Qu’est ce qui est cancérogène ?
Maintenant qu’on connait les bases génétiques du cancer, on va chercher à identifier quelles substances sont à même d’induire des cancers, ou pas. Et c’est là que réside toute la difficulté.
Quand on s’interroge sur la cancérogénicité d’une substance, le premier test à effectuer est un test de génotoxicité, ou mutagénicité. La génotoxicité est facile, et économique à déterminer. Il existe de nombreux tests, mais le plus connu d’entre eux est le test d’Ames : on expose une population bactérienne à la substance en question, et on observe ou non l’apparition de mutants. Les mutants sont détectés facilement par l’indépendance vis à vis d’un facteur de croissance bactérienne, l’histidine. Si la substance est génotoxique, le taux de mutations de l’ADN va augmenter, et la probabilité d’apparition d’une mutation rendant la bactérie indépendante à l’histidine va augmenter. Cette mutation sera rapidement sélectionnée car elle confère un avantage sélectif aux bactéries qui la possède.
Cependant, le modèle bactérien est un peu trop éloigné des cellules humaines pour suffire à obtenir une certitude sur la cancérogénicité d’une substance.
En plus, cette expérience ne prend pas en compte les éventuelles moifications métaboliques que peut subir une substance dans notre organisme avant d’atteindre nos cellules. Alors, on utilise un test sur le même principe, utilisant des cellules eucaryotes, avec des extraits de foie dans le milieu pour simuler un métabolisme. Mais ces modèles sont encore une fois imparfaits, et comme souvent en médecine, rien ne remplace l’expérimentation en conditions réelles, on en parlera plus tard.
Le problème majeur, en plus, n’est pas là. Le problème c’est que, la génotoxicité n’est parfois pas suffisante pour affirmer la cancérogénicité, et la cancérogénicité n’est pas toujours liée à une génotoxicité… Il existe plusieurs exemples de substances qui sont cancérogènes, de manière certaine, au moins chez l’animal, et qui ne sont pas du tout génotoxique.
Comment est-ce possible me direz-vous ?
La dieldrine, par exemple, un insecticide aujourd’hui interdit en France, est cancérigène mais non génotoxique. Le safrole, est cancérigène, mais non génotoxique, pourquoi ? Parce-qu’il subit une biotransformation qui aboutit à la formation d’un oxyde, lui, génotoxique.
Mais comment une substance peut-elle être cancérogène sans être génotoxique ? On a vu que le cancer était nécessairement lié à une altération de l’ADN ? Alors ?
En fait, c’est vrai, une substance peut-être cancérogène sans être génotoxique. And that’s the point. C’est ce qui rend la cancérogénèse si complexe.
En fait, il y a deux catégories de cancérogènes. Tout à l’heure, on a parlé de cellules initiées, vous savez, une fois qu’elles avaient perdu p53, la gardienne du génome. Pour initier une cellule, il faut nécessairement un génotoxique, qui va induire une mutation irréversible (ou réversion par mort de la cellule) de l’ADN.
Qui dit mutation, dit mutagène, on est bien d’accord.
Mais une fois cette mutation induite, on va entrer en phase de promotion. Et en phase de promotion, qui peut-être très longue, les cellules initiées vont être sélectionnées au sein du tissus par leur pouvoir cancérogène. Cette phase de promotion n’est possible que parce-que les cellules initiées ont perdu le gène p53, suppresseur de tumeur, ou acquis un autre oncogène, mais là, il n’est plus question de mutation induite, mais de sélection naturelle. Bien sur, la phase de promotion ne peut avoir lieue qu’après une activation des cellules, mais pendant cette phase, il n’y a plus besoin d’induire de nouvelles mutations. Les cellules sont capables de muter toutes seules.
Et c’est pendant la phase de promotion qu’interviennent principalement les cancérogènes non-génotoxiques. On les appelle les promoteurs, quand les génotoxiques sont dits initiateurs.
Le mode d’action de ces promoteurs peut-être très varié : il augmentent la prolifération cellulaire (huile de croton), jouent le rôle d’immunosuppresseur (médicaments), ont des effets mécaniques désorganisant les tissus (comme l’amiante, qui est aussi génotoxique), jouent sur les mécanismes hormonaux (oestrogènes), l’inflammation, … Ces mécanismes sont variés, et loin d’être tous connus. Les promoteurs diminuent en fait le temps de latence entre initiation et progression ; ils accélèrent la survenue d’un cancer, sans le causer directement, en accélerant la sélection naturelle au sein des cellules des tissus initiés.
Quelques exemples de promteurs : dioxine, huile de croton, les oestrogènes, phénol,…
Maintenant, il faut préciser que la distinction entre initiateur et promoteur est loin d’être absolue, et, souvent, les composés cancérogènes sont un peu des deux, comme le benzo(a)pyrène de la cigarette. Et pour finir sur cette notion, on considère que les initiateurs ont un effet sans seuil, ou stochastique, et auxquels une exposition unique peut suffire, quand les promoteurs ont eux une action à seuil, pour lesquels une expositio chronique et répétée est nécessaire.
Voilà pourquoi les expériences de génotoxicité sont insuffisantes pour déterminer de la cancérogénicité d’un agent.
Alors que nous reste-t-il ?
1) L’expérimentation à l’animal
2) Les études épidémiologiques
1) L’expérimentation animale : pas compliqué, on inocule les substances au rat ou à la souris, et on observe ou non l’apparition de cancers.
On essaie de mimer les voies d’inoculation avec elles prévisibles chez l’humain, et les doses au kg sont ramenées. Mais encore une fois, le modèle animal est imparfait : les biotransformations ne sont pas les mêmes, et les résultats ne sont pas toujours transposables.
2) Les études épidémiologiques
Méthode de choix, évidemment, car sur l’homme, et en condition réelles. Mais les études épidémiologiques sont longues et coûteuses à réaliser, il y a des contraintes méthodologiques importantes : il faut qu’il existe une population exposée à la substance que l’on souhaite étudier, car on ne peut évidemment pas exposer sciemment des personnes à des fins de recherche (bioéthique), et il faut suivre cette population, pendant plusieurs années, voire dizaine d’années. Et même lorsque des études épidémiologiques sont réalisées, l’imputabilité d’un éventuel risque accru de cancer est loin d’être aisée à réaliser, du fait de l’éventuel présence d’autres facteurs de risque omis par les investigateurs de telles études…
Quelques données statistiques en France
Les décès attribuables aux cancérogènes connus certains, issus d’un rapport de l’académie de médecine de 2007 :
Tabac : 50 562, Alcool : 22 670,Agents infectieux : 9077, Obésité et surpoids : 6229, Sédentarité : 5838, UV : 5614, TTT hormonaux : 5159, Cancers professionnels : 4328, Facteurs de reproduction : 2260, Polluants : 217.
Le tabac, multiplie par 10 le risque de cancer du poumon, et augmentent les autres cancers, bouche, larynx, pharynx, …
L’alcool augmente par 3,4 le risque de cancer de la bouche et par 2,4 le risque de cancer du larynx, notamment (1,5 pour le foie).
Agents infectieux : HBV – foie 18,8, HCV foie 31, HPV, cancer du col, cancer de l’oropharynx, Helicobacter pilori, cancer de l’estomac 2.
Professionnels : amiante, hydrocarbure et goudrons
Surpoids et obésité : Oesophage 2, rein 1,8, corps utérin 1,8
Sédentarité : colon et sein 1,3
Uv : mélanomes, les seuls mortels
Reproduction : l’âge du premier enfant, cancer du sein et de l’ovaire, et nomb d’enfants