Dossier présenté lors de l’épisode 222 du 9 juin 2015
De la lumière pour decouvrir la matière
De quoi est constituée la matière qui nous entoure ? Les tentatives menées pour répondre à cette question ont conduit les Hommes à élaborer des théories et à concevoir des méthodes de plus en plus performantes pour sonder la matière et découvrir les éléments. Au fil de ce cheminement, l’une des étapes clés est la naissance en 1859, d’une technique basée sur la lumière : l’analyse spectrale.
Exploration de la matiere : quelques repères historiques
Jusqu’au milieu du 17ème siècle, le courant de pensée dominant suggère que la matière est constituée d’une combinaison des quatre éléments que sont l’eau, la terre, le feu et l’air. Bien que cette vision de la matière initiée par Empédocle d’Agrigente (490-430 av. J.-C. environ) et consolidée par Aristote (384-322 av. J.-C.) ne correspondait pas à une théorie scientifique basée sur la vérification d’hypothèses grâce à l’expérience, elle a perduré pendant presque 2000 ans [, , ].
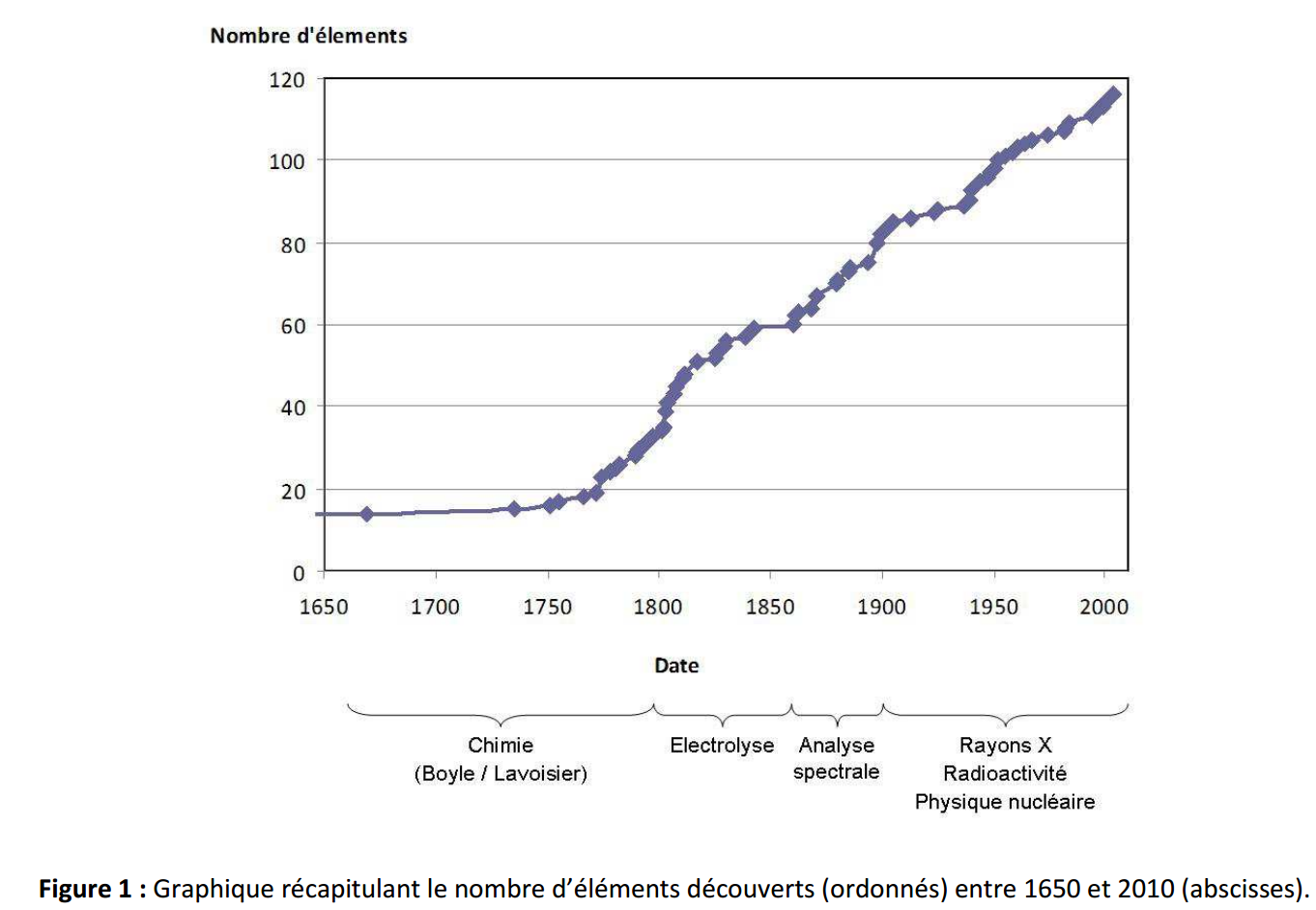
A la fin du 17ème siècle et durant le 18ème siècle, sous l’impulsion de Sir Robert Boyle (1627-1691) [] puis d’Antoine Laurent de Lavoisier (1743-1794) [], le concept des quatre éléments est progressivement remis en question. Il est alors établi qu’une matière est un élément si elle ne peut pas être décomposée expérimentalement en substances plus simples. Lavoisier, visionnaire, envisage même que les progrès techniques permettront de décomposer des substances paraissant indécomposables. Les expériences et les observations deviennent dés lors cruciales, les méthodes « chimiques » pour décomposer la matière s’enrichissent et permettent la découverte d’une vague de nouveaux éléments, passant d’une quinzaine connus en 1700 à une trentaine en 1800 (fig. 1) [1, 2, 3, , ].
Le début du 19ème siècle voit la naissance de la pile Volta [] et l’utilisation de l’électricité pour étudier la matière. Ceci entraîne la découverte d’une autre vague d’éléments, passant alors d’une trentaine connus en 1801 à une soixantaine en 1859 (fig. 1). [, , ]. C’est ainsi, par exemple, que Sir Humphry Davy (1778-1829) parvient à isoler le sodium (Na) et le potassium (K) en décomposant par électrolyse l’hydroxyde de sodium (soude – NaOH) et l’hydroxyde de potassium (potasse – KOH) qui paraissaient jusque-là indécomposables.
Au milieu du 19ème siècle une vingtaine d’éléments nouveaux sont isolés et l’analyse spectrale apparaît (fig. 1). Grace à cette nouvelle méthode d’investigation de la matière, définitivement mise au point par Robert Bunsen (1811-1899) et son collègue Gustav Kirchhoff (1824-1887), il n’est plus systématiquement nécessaire de décomposer une substance pour l’étudier []. Cette nouvelle technique expérimentale utilise la lumière comme un outil pour sonder la matière car tel une « signature » ou encore un « code barre lumineux », le rayonnement émis par un élément incorporé et chauffé dans une flamme lui est propre : c’est l’émission atomique [9, 10, , ]. Cette technique étant à l’origine de la majeure partie des méthodes modernes d’investigation de la matière, appelées spectroscopies, c’est elle qui sera étudiée dans la suite de cet article.
Tandis que la première moitié du 20ème siècle s’ouvre avec la découverte des rayons X et de la radioactivité, la seconde moitié du 20ème siècle s’ouvre avec l’apparition des accélérateurs de particules et des réacteurs nucléaires [9]. Ces découvertes et ces progrès techniques, entre autres, rendent l’exploration de la matière de plus en plus performante et du début du 20ème siècle à aujourd’hui, une cinquantaine d’éléments nouveaux ont été isolés (fig. 1).
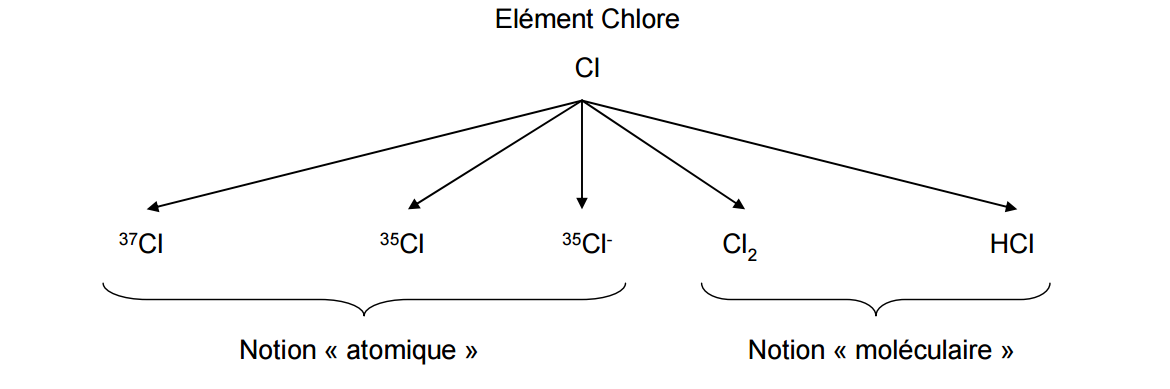
Ces repères temporels ne sont pas exhaustifs mais présentent quelques grandes évolutions techniques qui ont permis d’aboutir à la connaissance que nous avons actuellement de la constitution et de la structure de la matière. Ces connaissances prennent d’ailleurs en partie forme dans le tableau périodique des éléments. Par ailleurs, le terme « élément » désigne, aujourd’hui, un ensemble d’entités ayant le même numéro atomique, c’est-à-dire le même nombre de protons dans le noyau. Par exemple (fig. 2), le terme « élément chlore » (Cl) désigne aussi bien l’atome de chlore 35Cl (17 protons, 18 neutrons, 17 électrons), que l’atome de chlore 37Cl (17 protons, 20 neutrons, 17 électrons) ou que l’anion de chlore (chlorure) 35Cl– (17 protons, 18 neutrons, 18 électrons). Enfin, dans cet exemple, la molécule de dichlore Cl2 désigne le corps simple du chlore tandis que la molécule d’acide chlorhydrique HCl désigne l’un de ses corps composés.
Figure 2 : Les différentes notions regroupées sous le terme « élément ». Exemple autour de l’élément chlore.
L’émission atomique : un processus fondamental
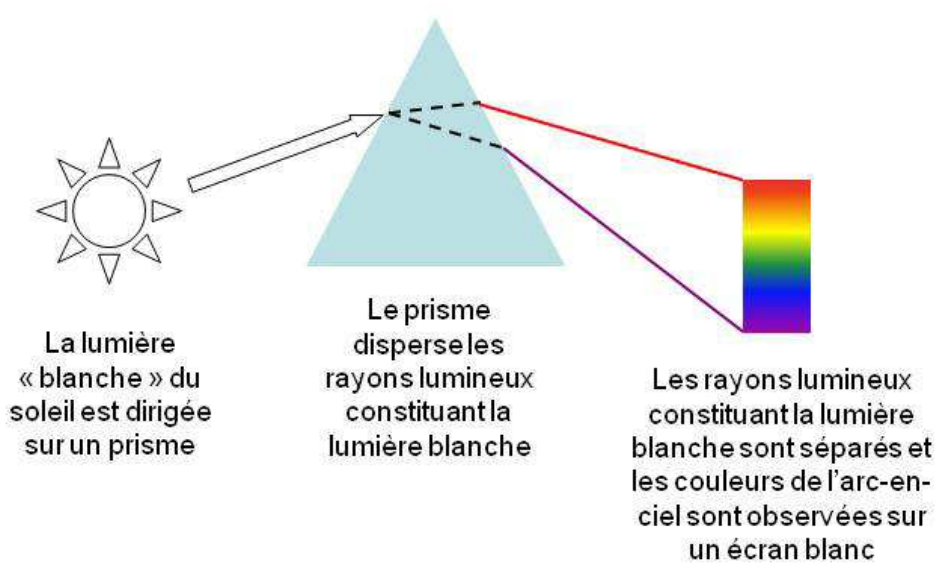
En 1672, Newton montre définitivement que la lumière blanche du soleil peut être décomposée (et recomposée), grâce à un prisme en verre, en une multitude de faisceaux colorés, il en dénombre sept différents, les fameuses sept couleurs de l’arc-en-ciel (fig. 3) []. Aujourd’hui, on sait que cette dispersion de la lumière résulte du phénomène de réfraction : la déviation d’un rayon lumineux de courte longueur d’onde (le violet) à travers un prisme, est plus importante que celle d’un rayon lumineux de grande longueur d’onde (le rouge).
Figure 3 : Principe de la dispersion de la lumière blanche par un prisme.
Si on introduit une substance dans la flamme légèrement bleutée d’un bec Bunsen, il est aisé de constater à l’œil nu que cette dernière change de couleur (fig. 4). Par exemple, la seconde colonne du tableau montre que l’ajout d’un sel de sodium, de lithium, de strontium, de calcium ou de cuivre colore la flamme respectivement en jaune, en rose fuchsia, en orange, encore en orange ou en vert. Si la distinction entre la flamme rose fuchsia et la flamme verte est facile à faire, la différence entre les deux flammes orange l’est déjà moins. Toutefois, en observant la lumière d’une flamme colorée à travers un prisme, il est possible de visualiser les différents raies lumineuses colorées qui la composent [12, , ]. Ainsi, la démonstration de Newton favorisera l’essor des premiers « spectroscopes » : outils permettant de visualiser, sous forme de spectres, les différents rayons lumineux constituant une lumière que notre œil perçoit homogène. Le spectroscope est donc l’outil contenant le prisme (ou un autre système dispersif tel qu’un réseau []) permettant de décomposer la lumière. Celui utilisé par Kirchhoff et Bunsen en 1859 était composé d’une caisse noircie dans laquelle était placé le prisme, d’une lunette dirigeant la lumière de la flamme sur le prisme et d’une lunette permettant d’observer le spectre d’émission [12].
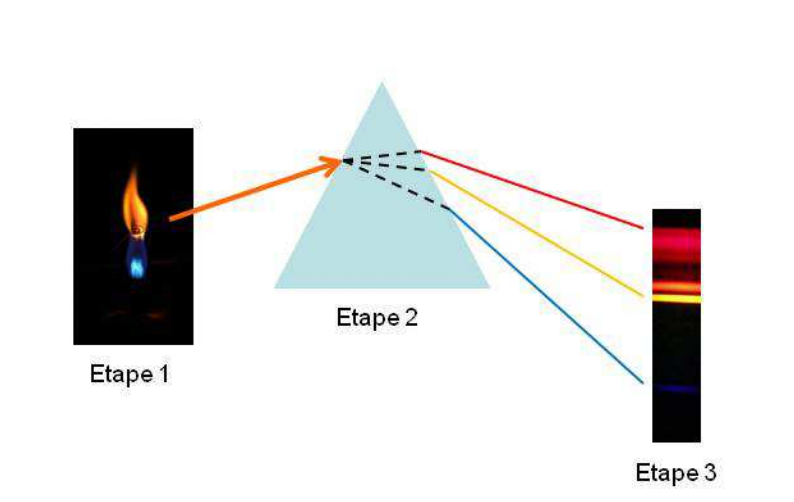
Ici, les résultats obtenus en l’utilisant un spectroscope sont des spectres d’émission atomique appelés spectres de raies. Pour comprendre comment fonctionne cet outil, décrivons l’expérience réalisée avec le sel de strontium (fig. 5). La lumière orange (paraissant homogène à l’œil nu) émise par le strontium introduit et chauffé dans une flamme (étape 1) est dirigée vers un système dispersif tel qu’un prisme. Celui-ci disperse cette lumière (étape 2) et le spectre d’émission observé à la sortie du spectroscope laisse apparaître plusieurs raies lumineuses colorées (étape 3). Ceci signifie que cette lumière orange est en réalité constituée de plusieurs faisceaux lumineux. Ces différentes raies colorées ainsi observées forment le « code barre lumineux » caractéristique du strontium.
La dernière colonne du tableau présente les spectres obtenus pour les cinq échantillons. Ils sont tous différents, caractéristiques de chaque élément introduit dans la flamme et constitués d’un nombre plus ou moins important de raies lumineuses, elles-mêmes plus ou moins fines. Ainsi, l’émission atomique donnant ces « codes barres lumineux » caractéristiques des éléments, est l’un des processus fondamental de l’analyse spectrale (le second étant l’absorption atomique).
Figure 4 : Couleur des flammes en fonction des sels introduits et chauffés dedans. Colonne 2 : photographies obtenues en introduisant une tige contenant le sel à étudier (sous forme de poudre) à l’intérieur de la flamme bleutée d’un bec Bunsen. Colonne 3 : spectres d’émission atomique obtenus à l’aide d’un spectroscope (dont le système dispersif est ici un réseau et non un prisme).
Figure 5 : Principe de fonctionnement d’un spectroscope utilisé pour décomposer la lumière produite par un sel de strontium chauffé dans une flamme légèrement bleutée d’un bec Bunsen. Etape 1 : introduction d’un sel de strontium dans la flamme ; étape 2 : décomposition de la lumière par un système dispersif tel qu’un prisme ; étape 3 : obtention et observation du spectre de raies du strontium.
de l’emission atomique a l’analyse spectrale
L’observation des premiers spectres d’émission atomique débute cent ans avant les travaux décisifs de Kirchhoff et Bunsen. En 1752 Thomas Melvill (1726-1753) observe à l’aide d’un spectroscope, les lumières colorées émises par des substances qu’il introduit dans une flamme. Mais ses travaux de recherches sont interrompus part sa mort prématurée à l’âge de 27 ans. Bien que d’autres scientifiques étudient à leur tour ce phénomène, il faut attendre 1826 pour que l’hypothèse selon laquelle ces spectres d’émission pourraient être caractéristiques des éléments introduit dans la flamme soit énoncée. Et ce n’est qu’en 1859 que cette intuition émanant de William Henry Fox Talbot (1800-1877) est définitivement confirmée par Kirchhoff et Bunsen [].
L’une des raisons principales pour laquelle un siècle s’est écoulé entre les premières observations de l’émission atomique et la naissance de l’analyse spectrale était la présence inexpliquée d’une raie lumineuse jaune dans quasiment tous les spectres observés, et cela quelque soit la substance étudiée. Aucun scientifique n’arrivait à l’attribuer de manière sûre à un élément précis et pire, comme elle était tout le temps présente, il était impossible de conclure sur le fait qu’un « code barre lumineux » était bien caractéristique d’un élément. L’explication sera finalement amorcée par William Swan (1818-1894) avant d’être confirmée à nouveau par Kirchhoff et Bunsen. Cette raie lumineuse jaune est celle caractéristique du sodium (fig. 4) et elle est très souvent observée car la sensibilité de cette technique est exceptionnelle. Il suffit seulement de quelques nanogrammes (1 ng = 10-9 g) de sodium dans une flamme pour obtenir sa raie lumineuse. Ainsi, comme il peut y avoir de faibles quantités de chlorure de sodium dans l’atmosphère, cette raie peut se retrouver dans de nombreux spectres : soit parce qu’il y en a suffisamment dans l’air ; soit parce qu’après avoir été exposé trop longtemps à l’air, une quantité suffisante de chlorure de sodium s’est déposé sur l’échantillon [12, 19, , ]. Une fois l’énigme de cette raie jaune élucidée sa présence éventuelle dans les spectres devient moins problématique car sont origine est connue.
Ayant découvert l’incroyable sensibilité de cette technique, Kirchhoff et Bunsen purifient le plus possible les échantillons qu’ils introduisent dans les flammes, afin d’éviter au maximum toutes pollutions dans les spectres d’émission qu’ils observent (pollution pouvant résulter de la présence d’une toute petite quantité d’une autre substance dans l’échantillon). Ils mettent également au point le fameux bec Bunsen, un brûleur capable de fournir une flamme très chaude et très peu lumineuse, juste légèrement bleutée. A la suite d’un travail colossal et minutieux au cours duquel ils comparent les spectres d’émission de plusieurs sels de sodium, lithium, potassium, strontium, calcium et baryum (qu’ils ont préparés et purifiés) introduits dans des flammes plus ou moins chaudes de flammes, ils concluent que chaque « code barre lumineux » est caractéristique d’un élément. C’est ainsi qu’en 1859 l’analyse spectrale est née : méthode basée sur la lumière à partir de laquelle il est possible de déterminer les éléments (ou au moins une partie d’entres-eux) constituants un petit échantillon de matière [12].
De l’analyse spectrale aux spectroscopies
L’analyse spectrale se révèle être une méthode d’analyse plus rapide, plus sûre, plus simple et plus sensible (une toute petite quantité d’échantillon suffit) que les méthodes d’analyses chimique de l’époque. Elle devient alors indispensable pour révéler la présence d’un ou plusieurs éléments différents dans une matière et pour découvrir de nouveaux éléments [21]. Sur ce dernier point, Kirchhoff et Bunsen découvrent en 1861 le césium (qui doit son nom à la présence, dans son spectre d’émission, de deux raies bleues : caesius en latin) et le rubidium (raie d’émissions rouge foncé : rubidus en latin). Puis en 1862 le thallium (raie d’émission verte : thallos en grec), et en 1863 l’indium (raie d’émission de couleur indigo) sont respectivement découverts par des scientifiques britanniques et allemands. Ce ne sont là que quelques exemples car au final la majeure partie de la vingtaine d’éléments découverts entre 1859 et 1900 sera due à cette méthode d’analyse [1, 15, 20, ].
Même si l’analyse spectrale évoquée ici est principalement centrée sur l’émission de lumière visible par la matière, il est toutefois important de mentionner que Kirchhoff et Bunsen ont également travaillé sur l’absorption de la lumière visible par la matière. Ils ont montrés que ces processus d’émission et d’absorption étaient liés et « inversés », notamment en étudiant les raies sombres du spectre solaire appelée raies de Fraunhofer [, ]. Par ailleurs, il existe d’autres rayonnements électromagnétiques et d’autres interactions entre ces rayonnements et la matière. Tout ceci sera regroupé au sein de la spectroscopie : la science qui étudie les interactions (émission, absorption et diffusion) entre la matière et les rayonnements électromagnétiques (fig.6). Le terme analyse spectrale n’est d’ailleurs plus vraiment utilisé aujourd’hui puisqu’il est englobé dans le terme spectroscopie optique : la spectroscopie qui traite des interactions entre la matière et les trois catégorie de rayonnements infrarouge, visible et ultraviolet [18, , , ].
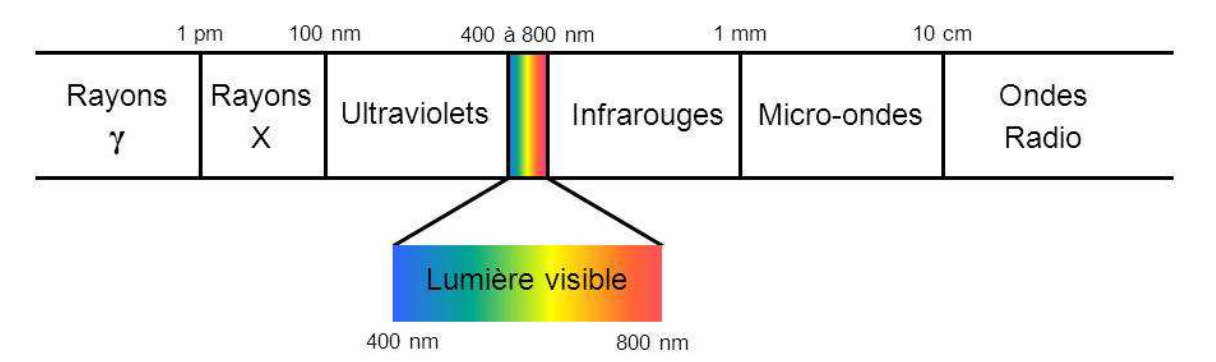
Figure 6 : On appelle communément lumière, ou lumière visible, un rayonnement électromagnétique dont les longueurs d’onde sont comprises entre 400 et 800 nm. Comme le montre cette figure, le spectre des rayonnements électromagnétiques est cependant bien plus grand que le seul domaine visible par l’homme (1 pm = 10-12 m et 1 nm = 10-9 m). [].
Il reste à souligner qu’une part importante de nos connaissances actuelles est issue de la spectroscopie. Par exemple en astronomie sur les étoiles, les nébuleuses et les galaxies [, ] ou encore en chimie sur la composition de la matière, sa structure et ses transformations []. A titre d’illustration, grâce à la spectroscopie le temps nécessaire pour identifier et trouver la structure d’une petite molécule contenant une quinzaine d’atomes de carbone est passé de 4 à 5 années au 19ème siècle à quelques jours maximum au 21ème siècle : une véritable révolution !
Au dela de l’exploration de la matiere : l’emission atomique amusante !
Il est désormais possible de trouver dans le commerce des bougies dont les flammes sont colorées grâce au processus d’émission atomique (fig. 7). Lors de la fabrication, les industriels incorporent dans la bougie des sels qui émettent une lumière colorée lors de la combustion. Par exemple des sels de lithium pour le rose, de sodium pour le jaune et de cuivre pour le vert ! Toutefois, l’incorporation directe de ces sels dans les bougies est délicate car ces derniers sont peu solubles dans le combustible (la « cire », aujourd’hui stéarine et paraffine) et la température de la flamme n’est généralement pas assez élevée pour avoir le processus d’émission atomique. Pour résoudre ces problèmes, une solution consiste à incorporer les sels dans des bougies dont le corps combustible est fabriquées à partir d’un mélange de stéarine et de triéthanolamine, car ce dernier composé permet de solubiliser les sels et d’augmenter la température de la flamme [16, , ].
Figure 7 : Photographie d’un gâteau sur lequel trois bougies à flammes colorées ont été disposées. A gauche : bougies éteintes. A droite : bougies allumées, en pleine combustion.
BIBLIOGRAPHIE
[[1]] R. Luft, Dictionnaire des corps purs simples de la chimie, Ed. : Nantes, Cultures et techniques, 1997, 391 p. [2] R. Luft, A propos des notions d’élément et d’atome, L’actualité chimique, 1991, (novembre-décembre), pp. 430-435. [3] B. Bensaude-Vincent, Regards sur l’histoire de l’élément chimique, Bulletin de l’union des physiciens, 1984, (78), pp. 1273-1284. [4] R. Boyle, The sceptical chymist, Printed by J. Cadwell for J. Crooke, London 1661, 442 p. [5] A. L. Lavoisier, Traité de chimie élémentaire, Ed. : J.-B. Dumas, E. Grimaux et F.-A. Fouqué (1864), 1789, (Tome 1), p. 7. [6] V. Polonovski, Le tableau périodique : de l’ordre dans les éléments, Revue découverte, 2014, (395), pp. 28-37. [7] B. Bensaude-Vincent, Le système périodique en perspective historique, Comptes Rendus de l’académie des sciences : Chimie, 2012, (15), pp. 546-552. [8] A. Volta, On the Electricity Excited by the Mere Contact of Conducting Substances of Different Kinds, Philosophical Transactions of the Royal Society of London, 1800, (90), pp. 403-431. [9] I. Brissaud et M. Bernas, Chronologie de la découverte des éléments chimiques et cycles de Kondratiev, L’actualité chimique, 2001, (novembre), pp. 35-40. [10] R. Wolf, Chimie et nature, Bulletin de l’union des physiciens, 2002, (96), pp. 657-675. [11] J. Al-Khalili, Les secrets de la matière : La naissance de la chimie, Production : BBC, Réalisation : J. Stephens, 2010, (51min), 42min20s-50min20s. [12] G. Kirchhoff, R. Bunsen, Analyse chimique fondée sur les observations du spectre, Annales de chimie et de physique, 1861, (Série 3, Tome LXII), pp. 452-486. [13] D. Sénéchal, Histoire des sciences, Note de cours de l’université de Sherbrooke, 2014, (PHQ 399), chapitre 8, http://www.physique.usherbrooke.ca/pages/sites/default/files/senechal/PHQ399_A4.pdf. [14] M. Guymont, Structure de la matière : atomes, liaisons chimiques et cristallographie, Ed. : Belin sup, 2003, chapitre 1. [15] J. Rosmorduc, Introduction à l’histoire de l’optique, Bulletin de l’union des physiciens, 1985, (79), pp. 1267-1283. [16] B. Valeur, La couleur dans tous ses éclats, Ed. : Belin – pour la science, 2011, 128 p. [17] J. Al-Khalili, Les secrets de la matière : L’ordre caché, Production : BBC, Réalisation : J. Stephens, 2010, (49min), 34min10s-36min35s. [18] P. Bouchareine, Spectrométrie optique, Techniques de l’ingénieur, 1994, (r6310), 31 p. [19] M. Saillard, Notes sur l’histoire de la spectroscopie : le problème posé par la raie jaune du sodium, Bulletin de l’union des physiciens, 1983, (77), pp. 1157-1158. [20] C. Genin, De l’analyse spectrale aux spectroscopies ; histoire et applications, Bulletin de l’union des physiciens, 2006, (100), pp. 235-246. [21] C. Genin, Kirchhoff et Bunsen fondent l’analyse spectrale, Bibnum, 2008, 10 p. [22] P. Avenas, A propos de l’indium, L’actualité chimique, 2013, (380), p.3. [23] B. Valeur, Lumière et luminescence : ces phénomènes lumineux qui nous entourent, Ed. : Belin – pour la science, 2005, 207 p.[24] L. Dettwiller, Observation des raies d’absorption du spectre solaire : Raies de Fraunhofer, Bulletin de l’union des physiciens, 1997, (91), pp. 1009-1012. [25] M. Farré, E. Martinez, D. Barcelo, Techniques de détermination de composé organiques dans l’environnement, Techniques de l’ingénieur, 2008, (p3820), 20 p. [26] A. Petit, Théorie des spectres atomiques, Techniques de l’ingénieur, 1999, (p2655), 21 p. [27] A. Petit, Théorie des spectres moléculaires, Techniques de l’ingénieur, 2002, (p2656), 21 p. [28] P. Atkins, L. Jones, Principes de chimie, Ed. : De Boeck Université, 2007, p. 6. [29] P. Boisse, La spectroscopie : un formidable outil pour comprendre l’univers ?, Conférence Canal U, 2009, (98min), http://www.canal-u.tv/video/cerimes/la_spectroscopie_un_formidable_outil_pour_comprendre_l_univers.9296 [30] J. Kieken, La lumière des étoiles, Revue Découverte, 2005, (330), pp. 45-50. [31] N. Trong Anh, La chimie : science des transformations, Conférence Canal U, 2000, (76min), 22min30s, https://www.canal-u.tv/video/universite_de_tous_les_savoirs/la_chimie_science_des_transformations.1084 [32] G. Durand, B. Legrand, B. Mokili, J.-P. Rives, Composition combustible produisant une flamme colorée, Brevet Européen, 2000, (EP 1049760 A1), http://www.google.fr/patents/EP1049760A1?hl=fr [33] L. Boyer, Feu et flammes, Ed. : Belin – pour la science, 2006, 189 p.